2022年3月Science期刊精华
时间: 2022-04-18 14:31:28 | 作者:CellMax | 来源: 喜蛋文章网 | 编辑: admin | 阅读: 97次
- 2023-11-29 04:59:20麻老虎是什么生物
- 2023-11-19 09:00:09【眼健康科普课堂】眼睛痒,揉一揉就可以了吗
- 2023-11-18 17:01:05针对高压电缆护层接地环流在线监测,有什么科普的吗
- 2023-11-17 10:01:13【科普小知识】阴生植物为什么不怕照不到阳光
- 2023-11-16 12:00:38求科普,王自如是谁,是干啥的
- 2023-11-15 01:01:52在科研圈“立山头”的现象为啥感觉渐渐要进入“科普圈”
- 2023-11-08 11:00:16科普教育: 结核防治的方法是什么
- 2023-11-04 11:00:34在知乎上看紫微斗数算科普嘛
- 2023-11-03 08:00:27硬核科普 | 按钮开关的那些冷知识,你都知道吗
- 2023-11-02 10:00:10为什么电影《流浪地球2》中未来几乎没有生物方面的突破

1.Science:重磅!揭示铜诱导的细胞死亡机制
doi:10.1126/science.abf0529
从细菌、真菌到植物和动物,铜都是生命的一个重要元素。在人类中,它与酶结合以协助于血液凝固、激素成熟和细胞处理能量。但是过多的铜会杀死细胞,如今科学家们找到了其中的原因。
在一项新的研究中,来自美国布罗德研究所的研究人员发现一种由铜诱导的新形式的细胞死亡。在布罗德研究所研究员Peter Tsvetkov和布罗德研究所主任Todd Golub的领导下,这些作者发现铜与专门的蛋白结合,导致它们形成有害的团块,并且还干扰了其他必需蛋白的功能,这会使得细胞进入毒性应激状态并最终死亡。相关研究结果发表在2022年3月18日的Science期刊上,论文标题为“Copper induces cell death by targeting lipoylated TCA cycle proteins”。
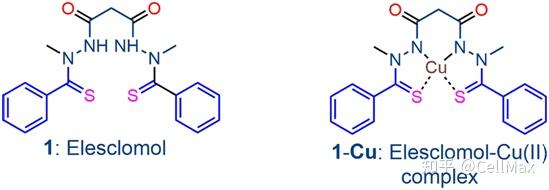

通过揭示这一过程的关键组成部分,这项新的研究还确定了哪些细胞特别容易受到铜诱导的死亡。这些发现可能有助于科学家们更好地了解出现铜失调的疾病,甚至可以为开发新的癌症治疗方法提供参考。
参考资料:
Peter Tsvetkov et al. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science, 2022, doi:10.1126/science.abf0529.
Martha A. Kahlson et al. Copper-induced cell death. Science, 2022, doi:10.1126/science.abo3959.
2.Science:组蛋白H3.1在DNA复制期间调节Tonsoku介导的DNA修复
doi:10.1126/science.abm5320
组蛋白(histone)是一种高度碱性的蛋白,在将DNA包装到染色体中起着关键作用。在一项新的研究中,来自美国耶鲁大学和加拿大渥太华大学的研究人员展示了组蛋白中最微小的生化变化如何对所有植物和动物中的DNA复制和修复至关重要。相关研究结果发表在2022年3月18日的Science期刊上,论文标题为“The histone H3.1 variant regulates TONSOKU-mediated DNA repair during replication”。
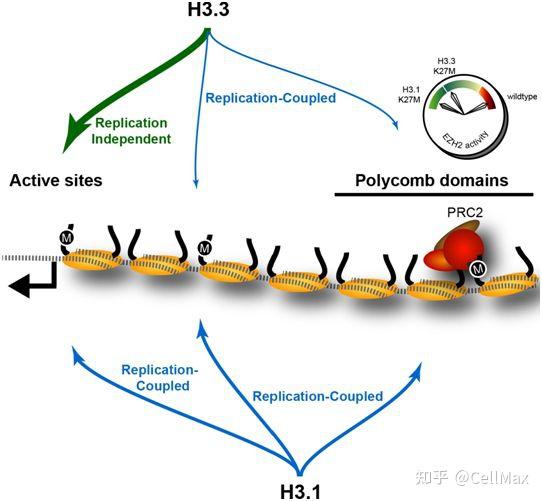

这些发现为组蛋白提供了新的见解。几十年来,生物学家们一直想知道为什么组蛋白的一种变体,即组蛋白H3.1,与它在遗传上几乎完全相同的组蛋白H3.3只有一个氨基酸的差异。
论文共同通讯作者、耶鲁大学分子、细胞与发育生物学助理教授Yannick Jacob及其团队利用开花植物拟南芥作为模型系统,揭示了对组蛋白H3.1关键作用的新见解。通过操纵这种植物的基因组,他们发现组蛋白H3.1的单一氨基酸变化在招募DNA复制过程中修复受损DNA所需的蛋白TONSOKU(TSK/TONSL)方面至关重要。
这些作者发现DNA修复蛋白TSK/TONSL通过组蛋白H3.1相互作用在DNA复制期间维持基因组稳定性。组蛋白H3.1的TPR(tetratricopeptide repeat)结构域对组蛋白H3.1的识别调节着这种DNA修复蛋白的活性。在从开花植物到哺乳动物中,组蛋白H3.1的这种作用可能是保守的。
参考资料:
Hossein Davarinejad et al. The histone H3.1 variant regulates TONSOKU-mediated DNA repair during replication. Science, 2022, doi:10.1126/science.abm5320.
3.Science:揭示细胞内钙离子释放在突触可塑性中起着关键作用
doi:10.1126/science.abm1670
在一项新的研究中,为了测试ICR是否参与经验依赖的可塑性,来自美国哥伦比亚大学的研究人员重点研究了海马体CA1区的锥体神经元(pyramidal neurons of hippocampal area CA1, CA1PN)。CA1PN接受来自多个传入回路的兴奋性输入,携带着关于动物环境的互补信息流,这些信息流冲击着CA1PN树突棘的不同区段。相关研究结果发表在2022年3月18日的Science期刊上,论文标题为“Compartment-specific tuning of dendritic feature selectivity by intracellular Ca2+ release”。
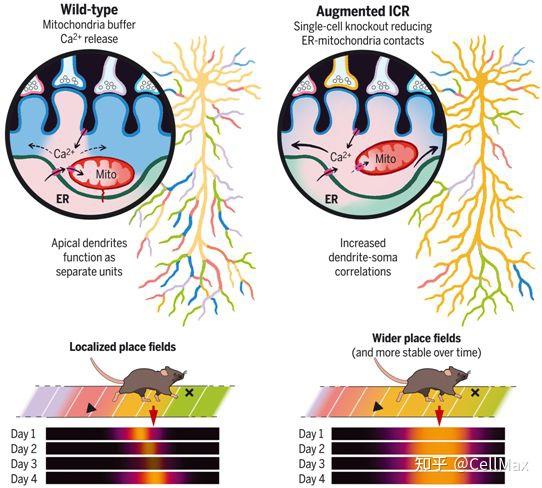

当动物探索一个新的环境时,CA1PN整合这些输入以形成空间调谐的接受域(receptive field),也称为位置域(place field),当动物占据一个特定的位置时,位置域表现为神经元放电。近期的研究描述了一种驱动位置域形成的体内可塑性机制:行为时间尺度可塑性(behavioral time-scale plasticity, BTSP)。BTSP是由一种较大的、长时间的树突去极化(高原电位)启动的,这种高原电位(plateau potential)最终增强了在与高原电位发生时间相对应的几秒钟的时间窗内收到的突触输入。
基于此,这些作者用CA1PN和BTSP作为模型系统来测试ICR是否参与了经验依赖的特征选择性的出现。他们实施了一系列基于单细胞电穿孔的工具,使得他们能够(i)利用条件基因缺失在单细胞分辨率下操纵ICR的细胞质影响,(ii)通过光遗传学手段诱导位置细胞,以及(iii)在空间导航期间同时对体细胞和树突的钙离子动态进行成像。
基因Pdzd8编码一种近期发现的内质网-线粒体连接蛋白,当被剔除时,会导致无限制的ICR。这些作者发现,在体内单个成年CA1PN中,Pdzd8的缺失大大增加了其顶端树突(apical dendrite)相对于CA1位置细胞胞体的空间共调谐水平,这一现象在基底树突(basal dendrite)中没有观察到,而在对照组CA1PN中,基底树突已与胞体高度共调谐了。最大化ICR导致更稳定地保留位置细胞的空间调谐,并改变其顶端树突的整合特性以形成输出水平的接受域。
参考资料:
Justin K. O'Hare et al. Compartment-specific tuning of dendritic feature selectivity by intracellular Ca2+ release. Science, 2022, doi:10.1126/science.abm1670.
4.Science:利用MPRA方法确定遗传变体和人类表型之间的联系
doi:10.1126/science.abj5117
在一项新的研究中,来自美国斯坦福大学的研究人员发现了在连锁不平衡(linkage disequilibrium)中有多个因果变体的等位基因无关调控位点(allele-independent regulatory site)的一个重要子集。相关研究结果发表在2022年3月18日的Science期刊上,论文标题为“Multiple causal variants underlie genetic associations in humans”。在这篇论文中,他们描述了他们如何将大规模并行报告基因检测(massively parallel reporter assay, MPRA)应用于人类基因组的某些部分,以寻找遗传变体和人类某些表型之间的联系。


科学家们多年来一直在研究人类基因组,寻找导致多发性硬化症等某些遗传疾病的变体。在这样做的过程中,他们发现在许多情况下,出错的不仅仅是一个基因,而是一系列基因的组合。为了确定哪些基因可能与某种疾病有关,科学家们开展了全基因组关联研究。虽然这类研究已经取得了丰硕的成果,但它们并没有带来追踪所有导致特定疾病的变体的方法。
作为这类研究的一部分,科学家们已经开始确定基因组中在统计学上与特定表型相关的某些区域。由于这类区域的间距很窄,将数量性状座位(quantitative trait loci, QTL)与因果遗传变体进行映射仍然是一个困难的问题。为了更多地了解变体和表型之间的可能联系,这些作者在这项新的研究中利用MPRA解决这个问题。
MPRA是分子水平的遗传分析工具,已被开发出来用于在一次试验中筛选成千上万的基因序列及其变体。这些作者发现,他们所研究的约17.7%的等位基因无关调控位点有一个以上的因果变体。他们还发现这类变体的影响往往比之前的研究表明的要弱---这一发现表明特定表型可能是由几个相关的因果遗传变体引起的。他们还利用来自MPRA的数据减少了可能导致一系列人类疾病(如多发性硬化症和哮喘)的因果变体的数量。他们最后建议,他们的研究和其他类似的研究也有助于寻找更多的罕见变体。
参考资料:
Nathan S. Abell et al. Multiple causal variants underlie genetic associations in humans. Science, 2022, doi:10.1126/science.abj5117.
5.Science:揭示甲烷氧化细菌如何将甲烷转化为燃料
doi:10.1126/science.abm3282
甲烷氧化细菌(methanotrophic bacteria)每年消耗3000万公吨的甲烷,并因它们将这种强大的温室气体转化为可用燃料的天然能力而吸引了科学家们。然而,我们对这种复杂的反应是如何发生的知之甚少,从而限制了我们利用这一双重优势的能力。在一项新的研究中,来自美国西北大学的研究人员通过研究甲烷氧化细菌用来催化这种复杂反应的酶,发现了驱动这一过程的关键结构。他们的发现最终可能导致人们开发出将甲烷气体转化为甲醇的人造生物催化剂。相关研究结果发表在2022年3月18日的Science期刊上,论文标题为“Recovery of particulate methane monooxygenase structure and activity in a lipid bilayer”。
这种称为颗粒甲烷单加氧酶(particulate methane monooxygenase, pMMO)的酶是一种特别难以研究的蛋白,因为它嵌入在甲烷氧化细菌的细胞膜中。通常情况下,当科学家们研究甲烷氧化细菌时,他们使用一种苛刻的程序,即用一种洗涤剂溶液将这种蛋白从细胞膜上撕下来。虽然这个过程有效地分离出这种酶,但这也杀死了它的全部活性,因而限制了人们能够收集的信息量。
在这项新的研究中,这些作者完全使用了一种新的技术。论文第一作者、Rosenzweig实验室博士生Christopher Koo想知道通过将这种酶放回类似于它的天然环境的膜中,他们是否能了解到一些新的东西。Koo利用来自甲烷氧化细菌的脂质在一种称为纳米盘(nanodisc)的保护性颗粒内形成一层膜,然后将这种酶嵌入这层膜中。
参考资料:
Christopher W. Koo et al. Recovery of particulate methane monooxygenase structure and activity in a lipid bilayer. Science, 2022, doi:10.1126/science.abm3282.
6.Science:杏仁基底外侧核中的多巴胺分泌促进大脑进入快速眼动睡眠状态
doi:10.1126/science.abl6618
在一项新的研究中,来自日本筑波大学和中国北京大学生命科学学院的研究人员发现杏仁基底外侧核(basolateral amygdala)中多巴胺的产生与快速眼动(rapid eye movement, REM)睡眠的启动之间存在关联。相关研究结果发表在2022年3月4日的Science期刊上,论文标题为“Rapid eye movement sleep is initiated by basolateral amygdala dopamine signaling in mice”。
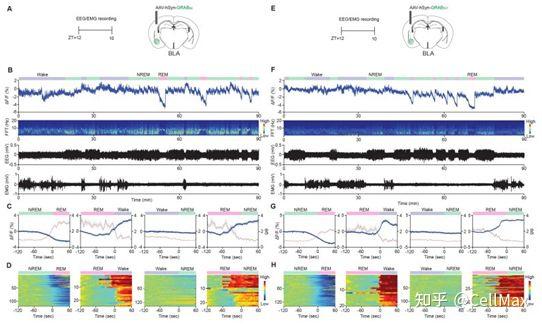

先前的研究已表明,人们在打瞌睡时在两种睡眠类型之间切换:非快速眼动(non-REM)睡眠和快速眼动(REM)睡眠。目前还不清楚的是在这两种睡眠之间切换的机制。在这项新的研究中,这些作者在小鼠身上使用光遗传学操作来了解这一过程。
这些作者的研究工作涉及首先观察到杏仁基底外侧核中的细胞在睡眠周期的不同部分被激活。在此过程中,他们发现仅在大脑进入REM睡眠之前,大脑该区域中的多巴胺分泌增加。类似的变化在non-REM睡眠期间并没有发生。这就表明,多巴胺水平的增加与推动大脑进入REM睡眠状态有关。为了测试这一点,他们在小鼠处于non-REM睡眠状态时,人为地刺激大脑杏仁基底外侧核中的多巴胺产生,并发现这样做可推动大脑进入REM睡眠状态。
参考资料:
Emi Hasegawa et al. Rapid eye movement sleep is initiated by basolateral amygdala dopamine signaling in mice. Science, 2022, doi:10.1126/science.abl6618.
Elda Arrigoni et al. Addicted to dreaming. Science, 2022, doi:10.1126/science.abo1987.
7.Science:揭示从头构建基因组的设计原则
doi:10.1126/science.abg0162
著名物理学家Richard Feynman有一句名言:“我不能创造的东西,我就不了解。”这句话不仅为Feynman的理论物理学方法提供了参考,也很好地描述了合成生物学家的动机,因为后者有兴趣从头开始构建基因组。通过设计和构建合成基因组,他们希望能更好地理解生命的密码。合成生物学一直是围绕着将DNA序列作为具有可复制功能的“部件(parts)”这一概念来组装的。如今,在一项新的研究中,通过成功的合作和对前沿工具的使用,欧洲分子生物学实验室(EMBL)的Lars M. Steinmetz团队对基因表达的变化有了重要的认识,这种变化是由这些DNA部件在基因组中的位置或背景造成的。相关研究结果发表在2022年3月4日的Science期刊上,论文标题为“Transcriptional neighborhoods regulate transcript isoform lengths and expression levels”。

论文共同第一作者、Steinmetz团队博士后研究员Amanda Hughes在解释激励这项研究的基本问题时说道,“在合成生物学中,你倾向于将事物分解成模块化的、‘即插即用’的部件。这些部件是启动子、编码区和终止子。我们想测试这些部件是否真地是‘即插即用’,在任何情况下都以同样的方式运作,或者它们的位置是否会影响其功能。我们想更好地了解基因的线性分布如何影响其功能,并确定可用于构建基因组的一般设计原则。”
这篇论文显示背景---特别是转录背景(transcriptional context)---改变了基因的RNA输出。通过使用长读直接RNA测序,他们能够观察到从合成酵母基因组中发生随机重排的DNA序列表达的全长RNA分子的起点、终点和数量的变化。基因的重新定位会影响其RNA输出的长度和丰度;然而,这些变化并不总是由新的相邻DNA序列来解释。似乎是发生在基因周围的转录,而不是它的序列本身,改变了它编码的RNA输出。
参考资料:
Aaron N. Brooks et al. Transcriptional neighborhoods regulate transcript isoform lengths and expression levels. Science, 2022, doi:10.1126/science.abg0162.
8.Science:构建出人类大脑血管的细胞图谱,确定一个新的免疫细胞群体与出血性中风相关联
doi:10.1126/science.abi7377作为一种破坏性的中风形式,出血性中风占美国所有中风病例的10%至15%,主要是在年轻人中发生。大约一半的出血性中风是致命的。在一项新的研究中,来自美国加州大学旧金山分校的研究人员将形成人类大脑血管的所有细胞以及它们所在的位置和每个细胞中转录的基因编成目录。由此产生的大脑血管的细胞图谱描述了40多种以前未知的细胞类型,包括一个免疫细胞群体,这个免疫细胞群体与大脑血管细胞的沟通有助于出血性中风的发生。这些发现将成为全球范围内对大脑血管开展新研究的基础。相关研究结果于2022年1月27日在线发表在Science期刊上,论文标题为“A single-cell atlas of the normal and malformed human brain vasculature”。
论文共同第一作者、加州大学旧金山分校威尔神经科学研究所研究助理Ethan Winkler博士说,“这项研究为我们提供了开始开发新疗法的靶标图谱和清单,这可能会改变我们治疗许多脑血管疾病的方式。”
参考资料:
Ethan A. Winkler et al. A single-cell atlas of the normal and malformed human brain vasculature. Science, 2022, doi:10.1126/science.abi7377.
9.Science:利用内源性标记构建出人类细胞蛋白分布图谱
doi:10.1126/science.abi6983
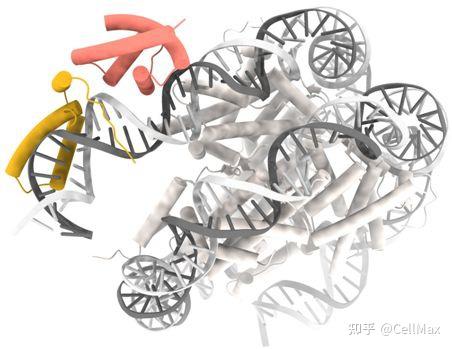
亚细胞定位和物理相互作用是与任何特定蛋白的功能紧密相关的关键方面。蛋白定位于不同的亚细胞区室,这使得细胞功能在空间上得到了分离。蛋白之间也有物理上的相互作用,形成将参与相同过程的蛋白连接起来的分子网络。因此,绘制细胞的分子分布图谱需要全面描述不同蛋白的定位位置以及它们如何相互作用。在其他策略中,绘制细胞结构的一种强有力的方法是利用与荧光蛋白“标签”的融合来可视化单个蛋白。这些标签不仅使我们能够对活细胞中的蛋白定位进行成像,而且还能通过作为免疫纯化-质谱分析(immunopurification–mass spectrometry, IP-MS)的手柄来测量蛋白相互作用。基因组工程的最新进展促进了对人类内源性基因的标记,从而使相应的蛋白可以在其天然的细胞环境中得到表征。

在一项新的研究中,来自美国、德国和丹麦的研究人员利用高通量的CRISPR介导的基因组编辑,构建出一个由1310个荧光标记的细胞系组成的文库。通过使用这个文库进行配对的IP-MS和活细胞成像,他们产生了一种绘制出相应的1310个蛋白的细胞定位和物理相互作用的大型数据集。相关研究结果发表在2022年3月11日的Science期刊上,论文标题为“OpenCell: Endogenous tagging for the cartography of human cellular organization”。
应用无监督聚类(unsupervised clustering)和机器学习相结合的方法进行图像分析,使得这些作者能够客观地识别具有共同空间或相互作用特征的蛋白。他们的数据提供了对单个蛋白功能的新见解,但也使他们能够推导出人类细胞结构的一些一般原则。特别是,他们发现,结合RNA的蛋白形成了一个独立的由特定的定位和相互作用特征定义的亚组。他们还发现,一种给定蛋白的精确空间分布与它的细胞功能密切相关,这样就可以从成像数据的分析中获得精细的分子见解。他们的开源数据集可以通过http://opencell.czbiohub.org的交互式网络界面进行探索。
参考资料:
Nathan H. Cho et al. OpenCell: Endogenous tagging for the cartography of human cellular organization. Science, 2022, doi:10.1126/science.abi6983.
10.Science:揭示Delta变体和疫苗引发的免疫力下降降低了mRNA新冠疫苗在家庭中的保护效果
doi:10.1126/science.abl4292
在一项新的研究中,来自美国耶鲁大学公共卫生学院的研究人员发现在Delta变体出现之前,Pfizer-BioNTech公司mRNA新冠疫苗在减少SARS-CoV-2在以色列家庭的传播方面的有效性超过91%。然而,随着时间的推移,Delta变体的出现和疫苗诱导的免疫力减弱的综合影响大大降低了这种疫苗对SARS-CoV-2传播的有效性。相关研究结果于2022年1月27日在线发表在Science期刊上,论文标题为“Vaccination with BNT162b2 reduces transmission of SARS-CoV-2 to household contacts in Israel”。

这些发现是基于对250万人---约占以色列人口的四分之一---的医疗信息的分析,这些医疗信息包含在一个集中式数据库中,该数据库由以色列国家授权的非盈利医疗服务机构Maccabi Health Services维护。
参考资料:
Ottavia Prunas et al. Vaccination with BNT162b2 reduces transmission of SARS-CoV-2 to household contacts in Israel. Science, 2022, doi:10.1126/science.abl4292.
11.Science:父母接种新冠疫苗也为儿童提供了实质性的保护
doi:10.1126/science.abm3087
在一项新的研究中,来自以色列克拉利特研究所、特拉维夫大学和美国哈佛大学的研究人员分析了世界上最大的综合健康记录数据库之一,来研究父母接种BNT162b2(辉瑞)新冠疫苗为未接种儿童提供的间接保护。相关研究结果于2022年1月27日在线发表在Science期刊上,论文标题为“Indirect protection of children from SARS-CoV-2 infection through parental vaccination”。
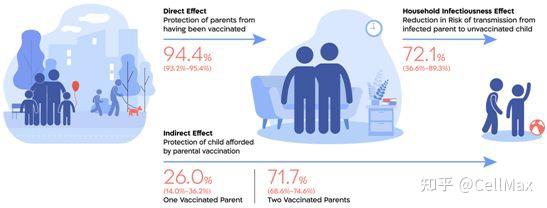

在2021年6月至2021年10月期间,一波由SARS-CoV-2的Delta变体主导的感染席卷了以色列。在此期间,这些作者研究了来自76621个不同家庭的181307名未接种疫苗的儿童,并将接种了第三剂疫苗(加强疫苗)的父母与至少在五个月前只接种了两剂疫苗的父母进行比较。这项研究估计,父母中仅有一人接种加强疫苗将儿童感染的风险降低了20.8%(95%置信区间:11.4%~29.1%),而父母两人都接种加强疫苗将儿童感染的风险降低了58.1%(95%置信区间:53.1%~62.6%)。
这些作者还在2021年12月至2021年3月的较早一波Alpha变体占优势的疫情期间进行了类似的研究。在此期间,他们研究了来自155305个不同家庭的400733名未接种疫苗的对象(儿童和青少年)。他们将未接种疫苗的父母与接受两剂疫苗的父母进行了比较,发现父母接种疫苗对儿童的间接保护甚至比上述更强。
参考资料:
Samah Hayek et al. Indirect protection of children from SARS-CoV-2 infection through parental vaccination. Science, 2022, doi:10.1126/science.abm3087.
[2022年3月Science期刊精华] 相关文章推荐:
- 最新经典文章
- 热门经典文章
- 热门文章标签
全站搜索