5分钟全面了解新冠病毒的致病原理:我们究竟在对抗什么
时间: 2021-08-03 15:27:30 | 作者:霸王花 | 来源: 喜蛋文章网 | 编辑: admin | 阅读: 125次
- 2023-10-29 15:00:03关于帕金森手抖的科普知识
- 2023-10-11 01:01:09我怎样才能做好科普知识的博主
- 2023-04-24 14:00:12有关艾滋病的科普知识有哪些
- 2023-03-07 12:01:23有哪些有趣的飞机的科普知识
- 2023-01-31 09:01:41加强儿童、老人等重点人群新冠科普知识宣传,如何加强对重点人群健康的管理
- 2022-12-10 17:00:23有哪些关于太阳的科普知识
- 2022-12-01 14:01:21有哪些可以分享给朋友的关于动物的科普知识
- 2022-10-21 22:01:59你体验过用VR虚拟仿真技术学习应急安全科普知识吗
- 2022-10-18 18:02:05如何将一个难一点的科普知识传授给小学生
- 2022-08-01 18:00:58不侵权科普知识视频素材怎么找

2021年1月至今,新型冠状病毒已经在全球肆虐了将近五个月。在可见的将来,全球共同抗疫将会成为新的常态。每天看着“新冠病毒”这四个字,你是否真的了解它?为什么它又被叫做肺炎?感染了新冠之后,你的体内会发生哪些变化?新冠病毒是如何在人体内繁衍的?RNA病毒究竟是什么意思?5分钟,知己知彼,百战不殆。
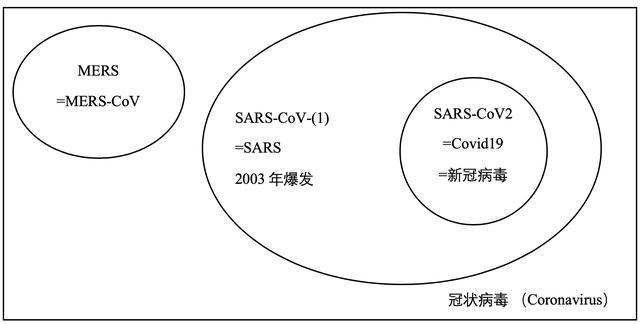

简单梳理一下新冠病毒和SARS的关系,以及它的各种名字。
- RNA病毒的生命周期
众所周知,新冠病毒是RNA病毒。也就是说,它的遗传物质与人类不同,不是双链的DNA,而是单链的RNA。
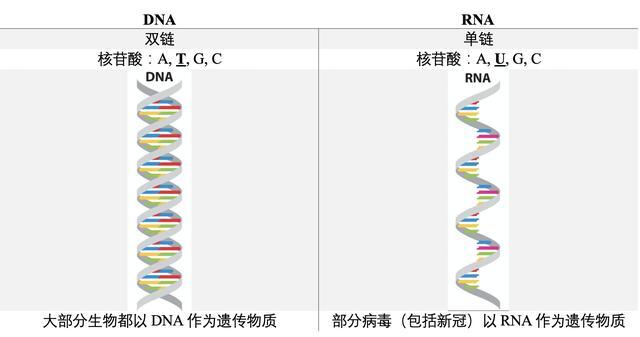

图1: DNA与RNA的区别。核苷酸可以想象成是一个个组成链子的单元。
RNA病毒的传播方式大同小异。
因为病毒的包膜和生物细胞的细胞膜都是由磷脂双分子层(lipid bilayer)组成的。所以,在一些特定蛋白的帮助下,两者可以轻易地融合。需要注意的是,包膜上除了磷脂,还有各种蛋白,而病毒为了防止自己包膜表面的蛋白被细胞识别、产生排异反应,常常会在与细胞膜融合之后,利用现有的细胞膜将自己包裹,伪装成生物体内的一部分(图2,步骤一)。


图2: RNA病毒的生命周期[1]。
顺利入侵之后,病毒便会在自己的包膜上打开一个口子,将自己的RNA注入到宿主细胞内。这里需要简单回忆一下我们体内蛋白质合成的步骤——DNA会被转录为mRNA,然后mRNA在核糖体(ribosome)和tRNA的翻译下,利用细胞内的氨基酸合成蛋白 (图3)。
病毒的RNA进入宿主细胞后,其中的一部分会强势取代宿主的mRNA。因为大家都是单链RNA,宿主细胞根本不会发现。于是,病毒的RNA就可以明目张胆地假公济私——利用宿主细胞的核糖体,tRNA,氨基酸和能量,去合成自己需要的蛋白(图2,步骤3a, 4, 5a&b)。另外一部分病毒RNA则会不断自行复制,成为未来第二代病毒的遗传物质(图2,步骤3b, 6)。最后,利用现成的宿主细胞膜,在上面组装好自己的蛋白,包住刚刚复制完成的RNA,新的病毒就诞生了(图2,步骤7)。
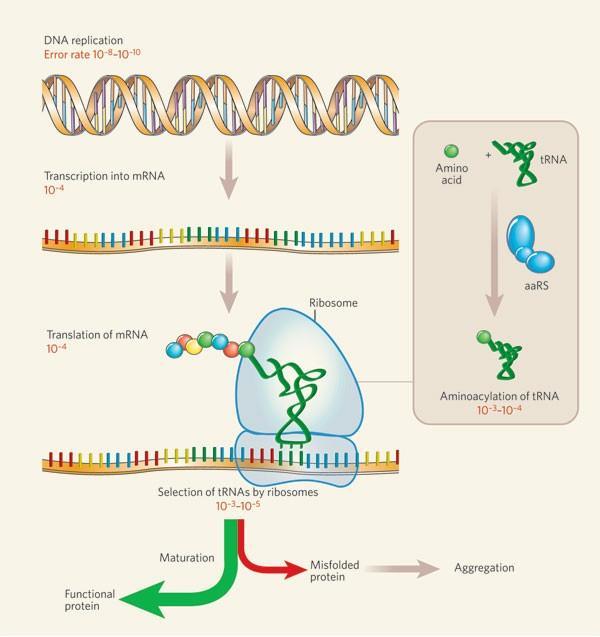

图3: 生物体内的蛋白质合成路径[2]。
这种无本万利的繁衍模式极大地促进了RNA病毒的传播。
- 新型冠状病毒的致病原理
新冠作为RNA病毒的一员,它的生命周期与大部分的RNA病毒相似。最大的区别就是新冠对于宿主细胞的选择以及与宿主细胞膜的融合方式。这两点都归因于一个重要的蛋白——棘突蛋白(spike protein)。
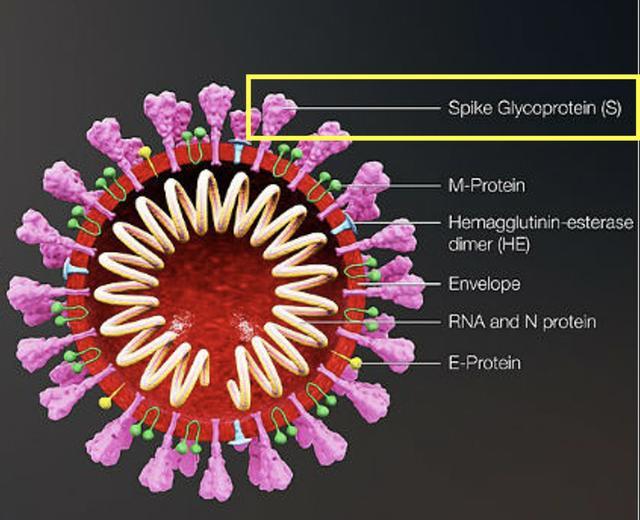

图4: 新冠病毒的结构剖析图[3]。粉红的结构为棘突蛋白。
图4中粉红色的结构只是一个大致的模拟图,这个蛋白的真实结构如图5所示。可以发现,因为这个SARS,MERS等病毒家族特有的蛋白长得比较像一个王冠,所以科学家便把它们统一命名为冠状病毒[5]。
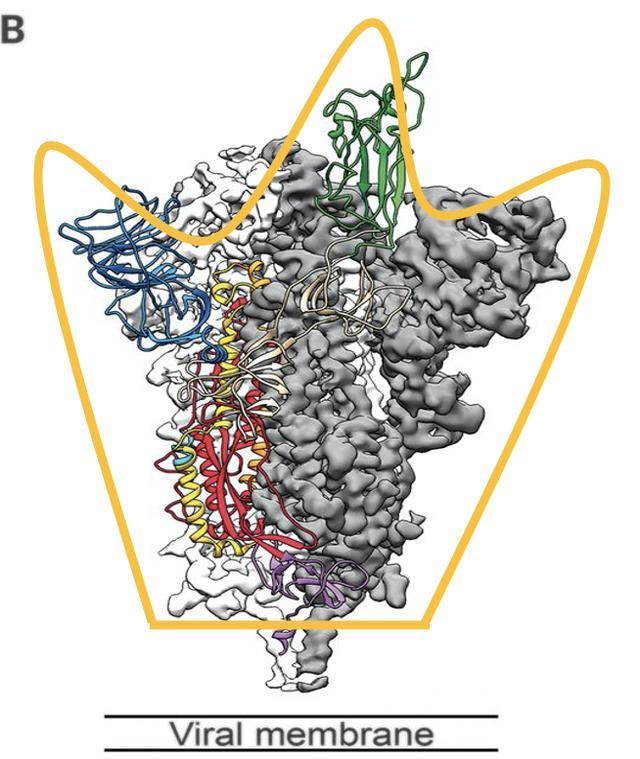

图5: 新冠棘突蛋白的晶体结构[4]。黄色形如鸡爪的王冠是笔者后来加的。
在新冠病毒通过各种渠道进入呼吸道之后,它会顺着呼吸道,进入我们的肺部,最终安家在alveoli,也就是肺泡里面(图6)。
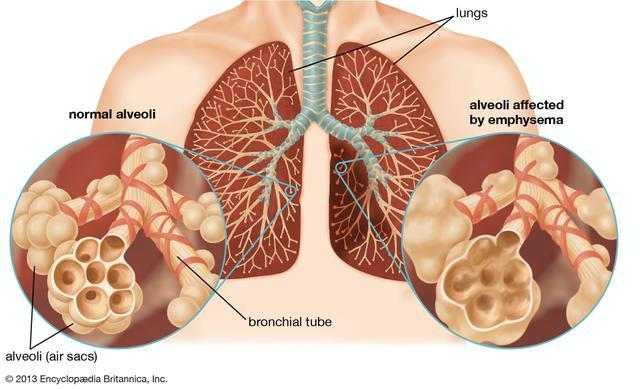

图6: 肺部结构及示意图[6]。
肺泡中有两种细胞,一类和二类. 一类是图7上方小而薄的细胞,用于气体的交换。但是它们不是重点,因为新冠病毒对它们不感兴趣。这个病毒喜欢的是二类细胞,也就是图7中那个大得有些突兀的细胞[7]。
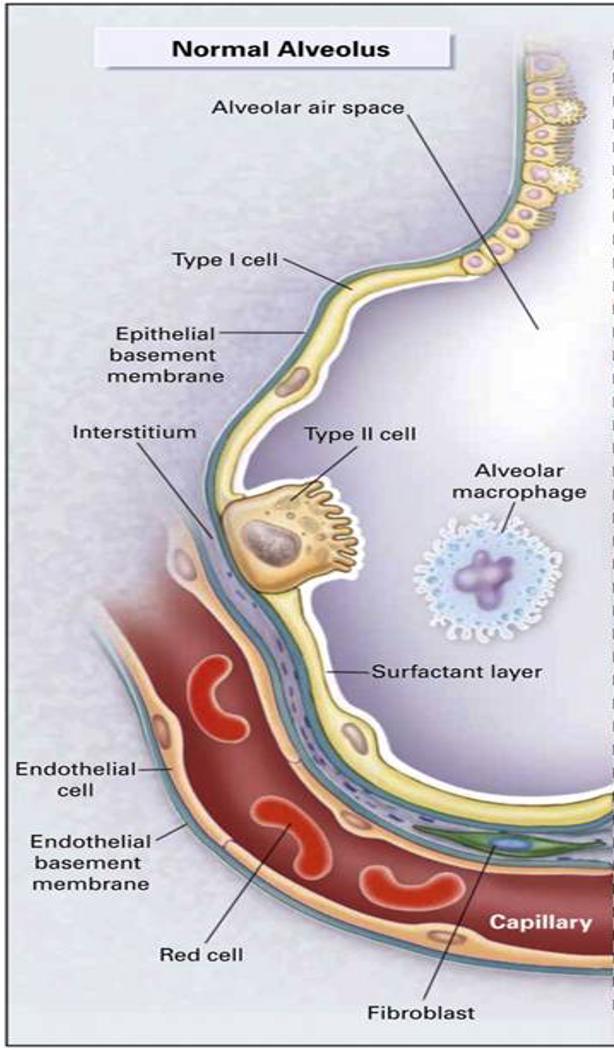

图7: 肺泡内部结构示意图[8]。
这些二类细胞会分泌一种叫Pulmonary surfactant 的物质。Pulmonary的意思是“和肺相关的”,而surfactant是一个复合词,它是由surf(ace) act(ive) a(ge)nt组成的,很明显它的意思就是在表面活跃的物质。Pulmonary surfactant是一种由脂质和蛋白组成的、覆盖在肺泡内壁的物质[9]。也就是图7里那一层奶白色的东西。
为什么这个由二类细胞分泌的pulmonary surfactant很重要,被新冠破坏的后果很严重呢?
人体内环境有许多水分子,肺泡也不例外。水分子之间会形成氢键,虽然氢键是比较弱的键,但是一堆水分子在一起形成一堆键之后,就会组成一张力度比较强的网,形成表面张力,也就是图8中的那一个蓝色的圈。因为肺泡内水分子数量有限,这张网有限的面积限制了肺泡的表面积。而有了pulmonary surfactant之后,脂质和蛋白会破坏水分子键的氢键,进而破坏这张网,增加肺泡的表面积以及体积[9]。
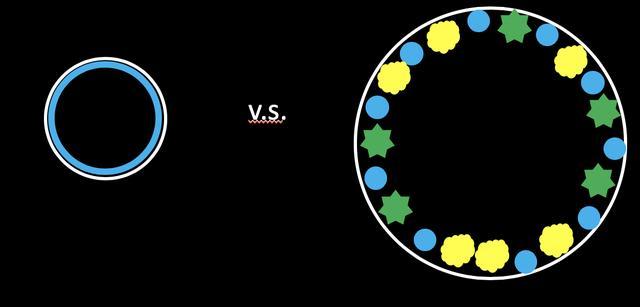

图8: pulmonary surfactant对于肺泡体积的影响示意图。白圈=肺泡;蓝=水分子;黄=脂质;绿=蛋白质
新冠病毒进入肺泡之后,会攻击这些二类细胞,使肺泡之内无法再形成pulmonary surfactant。肺泡的体积缩小之后(图9),无法满足我们日常活动的供氧需求,所以我们肺部的肌肉就会不停扩张,试图增加肺泡的体积。于是,在不断扩张的肺部肌肉和已经崩塌的肺泡之间,便会形成一块气压很低的区域,让炎性积液趁虚而入[7,10]。
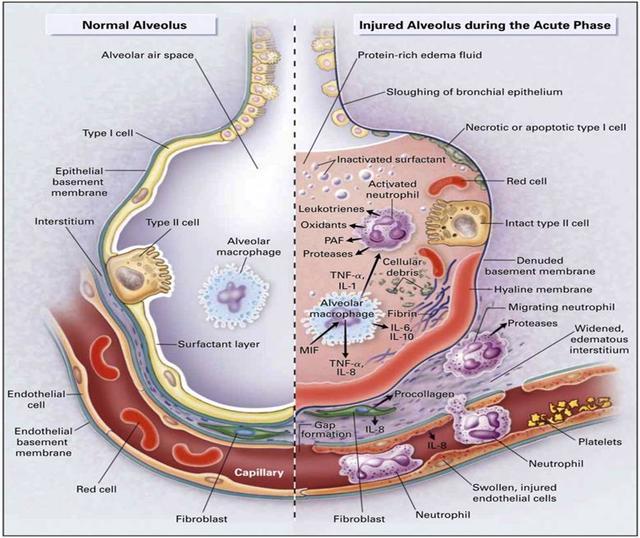

图9: 肺泡收缩前后对比图[8]。注意这张图并不是新冠病毒入侵前后的示意图!!!
棘突蛋白可以帮助新冠病毒的包膜和二类细胞的细胞膜融合(图2,步骤一)。因为新冠的棘突蛋白蛋白与SARS的基本一致[4],所以很大程度上可以根据SARS棘突蛋白的功能合理推断这个蛋白在新冠病毒上的作用。
首先,棘突蛋白的S1部分(图10)会和二类细胞细胞膜上的一个叫GRP78 (Glucose Regulated Protein 78)的蛋白受体(receptor)结合[11],使蛋白下方橘黄色的S2发生结构变化[13]。
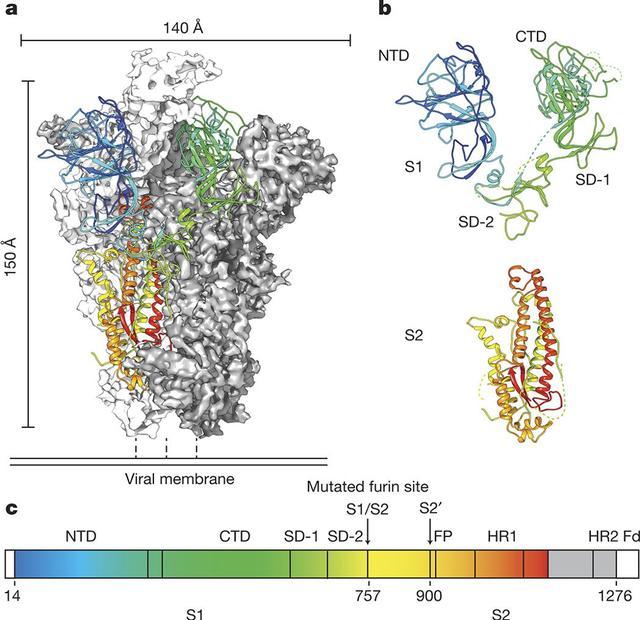

图10: 冠状病毒(SARS-CoV1)棘突蛋白的晶体结构[12]。
橘黄色S2的结构变化会让S1中绿色的受体结合域(RBD)竖起,以便棘突蛋白更好地与宿主细胞膜上的受体(receptor)结合 [4,14]。
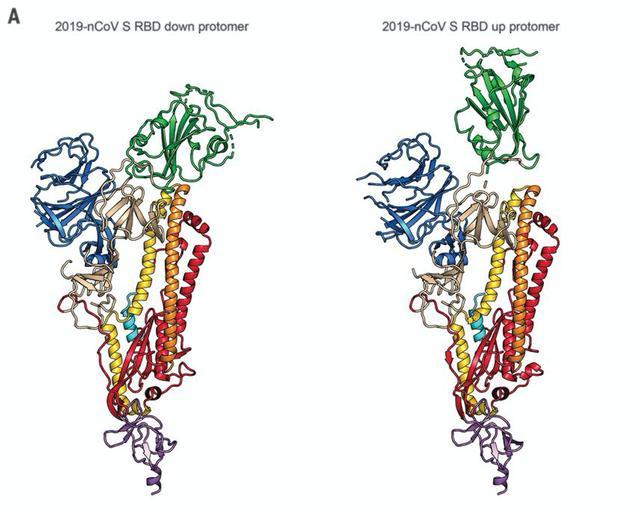

图11: 新冠病毒棘突蛋白在与宿主细胞膜上的GRP78结合前后的结构变化[4]。RBD=receptor binding domain
从图12的俯瞰视角上可以发现,在绿色的RBD打开之后,橘黄色的S2就很大程度上暴露了出来。这样一来,S2中的融合肽(fusion peptide),也就是辅助细胞膜融合的多肽,就能与二类细胞的细胞膜接触。最后,在融合肽(fusion peptide)的帮助下,新冠的包膜与二类细胞的细胞膜融合[15],病毒就可以把自己的RNA注射到二类细胞内。后面的步骤相信认真读到这里的你都知道了。
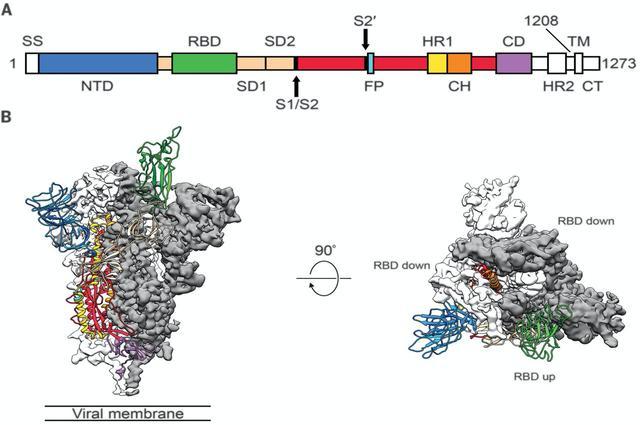

图12: 新冠病毒棘突蛋白的晶体结构正视图以及俯视图[4]。
- 预告
新冠病毒为什么让人谈之色变?它变异了吗?它有多大的可能是人造的?疫苗是如何研发的?之后的文章应该会围绕这几个问题展开。当然,这里列出来的许多问题都没有一个所谓“正确”的答案,我们所能做的,就是找到现有的科研成果,在此基础上进行合理地推测。
注:如果在找文献的过程中发现其他有趣的论文,之后的文章也可能会歪一下楼。
- Reference
[1]: https://en.wikipedia.org/wiki/Viral_replication
[2]: Roy, H., & Ibba, M. (2006). Sticky end in protein synthesis. Nature, 443(7107), 41–42. doi: 10.1038/nature05002
[3]: https://www.thepharmaletter.com/article/medicago-claims-to-have-a-viable-vaccine-candidate-for-covid-19
[4]: Wrapp, D., Wang, N., Corbett, K. S., Goldsmith, J. A., Hsieh, C.-L., Abiona, O., … Mclellan, J. S. (2021). Cryo-EM Structure of the 2021-nCoV Spike in the Prefusion Conformation. doi: 10.1101/2021.02.11.944462
[5]: Almeida JD, Berry DM, Cunningham CH, Hamre D, Hofstad MS, Mallucci L, McIntosh K, Tyrrell DA (November 1968). "Virology: Coronaviruses". Nature. 220 (5168): 650. Bibcode:1968Natur.220..650.. doi:10.1038/220650b0.
[6]: https://www.britannica.com/science/emphysema
[7]: Ziegler, C., Allon, S. J., Nyquist, S. K., Mbano, I., Miao, V. N., Cao, Y., … Network, H. L. B. (2021). SARS-CoV-2 Receptor ACE2 is an Interferon-Stimulated Gene in Human Airway Epithelial Cells and Is Enriched in Specific Cell Subsets Across Tissues. SSRN Electronic Journal. doi: 10.2139/ssrn.3555145
[8]: https://www.cancertherapyadvisor.com/home/decision-support-in-medicine/critical-care-medicine/acute-respiratory-distress-syndrome-acute-hypoxemic-respiratory-failure-non-cardiogenic-pulmonary-edema-high-permeability-pulmonary-edema/
[9]: Edwin JA Veldhuizen, Henk P. Haagsman. Role of pulmonary surfactant components in surface film formation and dynamics. Biochimica et Biophysica Acta BBA Biomembranes. 2000; 1467: 255-270.
[10]: Lorenzo, B. (2021). Wrapp, D., Wang, N., Corbett, K. S., Goldsmith, J. A., Hsieh, C.-L., Abiona, O., … Mclellan, J. S. (2021). Cryo-EM Covid-19, Type II Alveolar Cells and Surfactant. Journal of Medical-Clinical Research and Reviews, 1-3.
[11]: Ibrahim, I., Abdelmalek, D., Elshahat, M., & Elfiky, A. (2021). COVID-19 Spike-host cell receptor GRP78 binding site prediction. doi: 10.21203/rs.2.24599/v1
[12]: Kirchdoerfer, R. N., Cottrell, C. A., Wang, N., Pallesen, J., Yassine, H. M., Turner, H. L., … Ward, A. B. (2021). Pre-fusion structure of a human coronavirus spike protein. Nature, 531(7592), 118–121. doi: 10.1038/nature17200
[13]: Walls, A., Tortorici, M., Snijder, J., Xiong, X., Bosch, B., Rey, F., & Veesler, D. (2021). Tectonic conformational changes of a coronavirus spike glycoprotein promote membrane fusion. doi: 10.2210/pdb6b3o/pdb
[14]: Gui, M., Song, W., Zhou, H., Xu, J., Chen, S., Xiang, Y., & Wang, X. (2021). Cryo-electron microscopy structures of the SARS-CoV spike glycoprotein reveal a prerequisite conformational state for receptor binding. Cell Research, 27(1), 119–129. doi: 10.1038/cr.2021.152
[15]: Heald-Sargent, T., & Gallagher, T. (2021). Ready, Set, Fuse! The Coronavirus Spike Protein and Acquisition of Fusion Competence. Viruses, 4(4), 557–580. doi: 10.3390/v4040557
[5分钟全面了解新冠病毒的致病原理:我们究竟在对抗什么] 相关文章推荐:
- 最新经典文章
- 热门经典文章
- 热门文章标签
全站搜索